Vorkommen, Herstellung und Verbindungen, Verwendung
Vorkommen
Elementares Fluor kommt aufgrund seiner hohen Reaktivität in freier Form in der Natur nicht vor. Es tritt daher unter natürlichen Bedingungen fast nur in Form von Fluoriden und diversen Fluorkomplexsalzen (z. B. Natriumhexafluoridoaluminat = Kryolith) auf.
Einige wenige Organismen können fluororganische Verbindungen herstellen. Der südafrikanische Busch Gifblaar und weitere Pflanzenarten der Gattung Dichapetalum können Fluoressigsäure synthetisieren und in ihren Blättern speichern. Dies dient zur Abwehr von Fressfeinden, für die Fluoressigsäure tödlich wirkt.
Größere Fluoritvorkommen existieren in Mexiko, China, Südafrika, Spanien und Russland. Auch in Deutschland, etwa bei Wölsendorf in der Oberpfalz findet sich Fluorit.
Fluor kommt daneben auch in einigen seltenen Mineralen als Bestandteil vor. Ein Beispiele ist der Schmuckstein Topas.
Quellen: Fluor - Chemie-Schule; Fluor (chemie.de)

Fluoridkristalle
https://upload.wikimedia.org/wikipedia/commons/1/1f/Fluorite_crystals_270x444.jpg
https://images.acvmagazine.com/file/BIT-Magazine-Images/965321757471982.jpg
Herstellung und Verbindungen
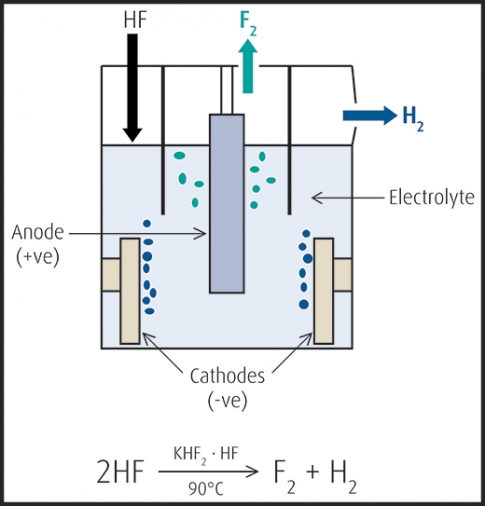
Aus Fluoriden kann elementares Fluor insbesondere auf elektrochemischem Weg gewonnen werden.
Das Ausgangsmaterial für die Gewinnung von elementarem Fluor und anderer Fluorverbindungen ist überwiegend Fluorit CaF2. Aus diesem wird durch Reaktion mit konzentrierter Schwefelsäure Fluorwasserstoff gewonnen.
CaF2+H2SO4⟶CaSO4+2 HF Reaktion von Calciumfluorid mit Schwefelsäure.
Eine weitere Quelle für Flusssäure ist die Phosphatgewinnung, bei der Flusssäure als Abfallprodukt bei der Verarbeitung von Fluorapatit entsteht. Nur ein kleiner Teil der produzierten Flusssäure wird zu elementarem Fluor weiterverarbeitet. Der größte Teil wird direkt zu anderen fluorierten Verbindungen verarbeitet.
Da Fluor eines der stärksten Oxidationsmittel ist, kann es auf chemischem Weg nur sehr umständlich und nicht wirtschaftlich gewonnen werden. Stattdessen wird ein elektrochemisches Verfahren eingesetzt.
2 HF⟶H2+F2
Verbindungen von Fluor und Sauerstoff sind sehr instabil. Wasser H2O schnappt sich das Fluor und bildet HF /Flusssäure), eine sehr starke, giftige Säure.
2F2 (g) + 2H2O (I) -> O2 (g) + 4HF (ag)
Mit Wasser reagiert Fluor bei verschiedenen Bedingungen unterschiedlich. Werden geringe Mengen Fluor in kaltes Wasser geleitet, bildet sich Wasserstoffperoxid und Flusssäure.
F2 + H2O -> H2O2 + 2HF
Quellen: Fluor - Chemie-Schule; https://de.wikipedia.org/wiki/Fluo
Verwendung
Auf Grund der hohen Reaktivität und des schwierigen Umgangs mit Fluor kann elementares Fluor nur eingeschränkt verwendet werden. Es wird überwiegend zu fluorierten Verbindungen weiterverarbeitet, die auf andere Weise nicht hergestellt werden können.
An dieser Stelle stelle ich zwei Beispiele für die Verwendung von reinem Fluor vor. Fluor dient zur Oberflächenfluorierung von Kunststoffen. Dies wird für Kraftstofftanks in Automobilen eingesetzt und bewirkt eine niedrigere Benzindurchlässigkeit. Die Technik wird in den Industriestaaten zunehmend durch andere Verfahren ersetzt. Der Umgang mit dem äußerst gefährlichen Fluor in der Tankproduktion wird hierdurch vermieden.
Ein zweites wichtiges Produkt, das nur mit Hilfe von elementarem Fluor hergestellt werden kann, ist Schwefelhexafluorid. Dieses dient als gasförmiger Isolator beispielsweise in Hochspannungs-schaltern und gasisolierten Rohrleitern.
In unserer Zahnpasta ist Fluorid enthalten, also kein reines Fluor. Es sorgt dafür, dass unsere Zähne gegen Säuren viel weniger empfindlich sind. Schaut euch dazu auch folgendes Video an.
Quelle: Fluor - Chemie-Schule

Fluorid
https://th.bing.com/th/id/OIP.3IWlPLiaXnwHsee2bLqrbwHaEO?w=294&h=180&c=7&r=0&o=5&dpr=2&pid=1.7
